国家药监局首次公示突破性疗法名单:传奇生物免疫疗法入选
8月5日,国家药监局(NMPA)药品审评中心(CDE)首次公示突破性治疗药物名单,传奇生物(LEGN.US)旗下LCAR-B38M CAR-T细胞自体回输制剂(简称:LCAR-B38M细胞制剂)成为首个拟纳入突破性治疗药物名单的药物。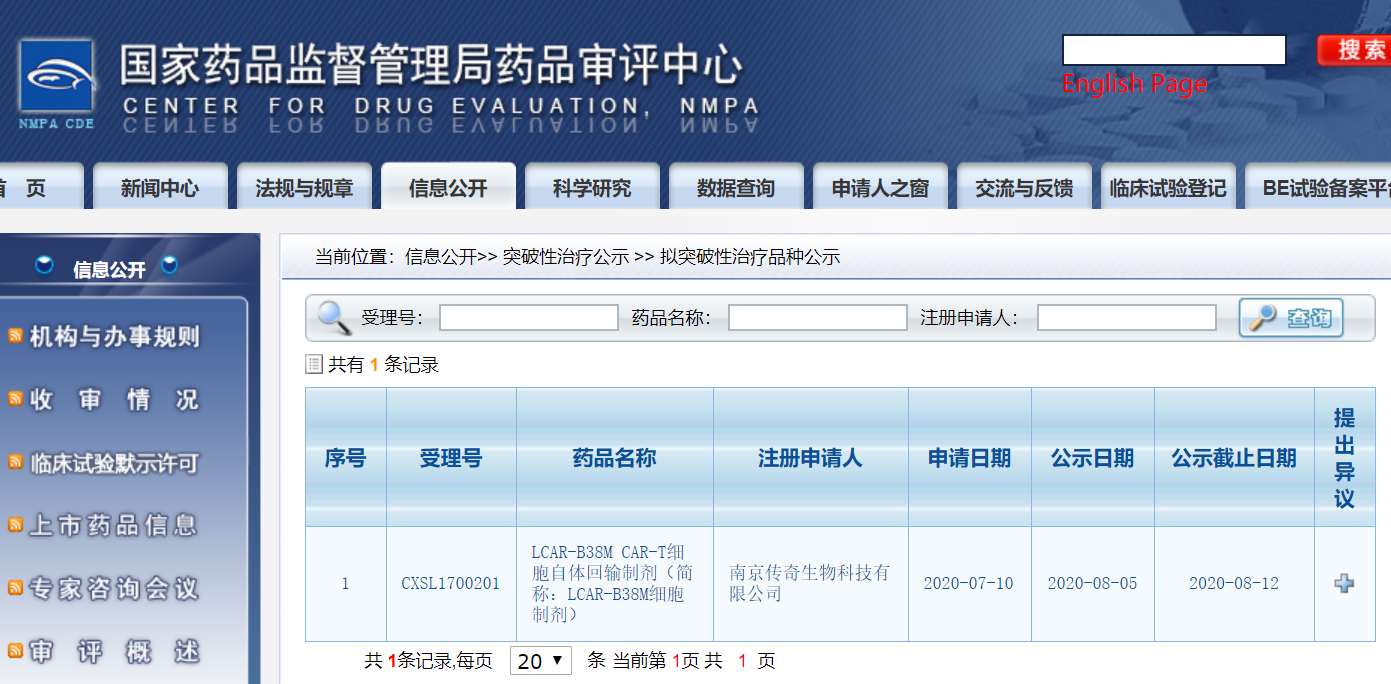 药审中心关于拟突破性治疗品种公示截图此前的7月8日,国家药监局发布《突破性治疗药物审评工作程序(试行)》,该文件旨在鼓励研究和创制具有明显临床优势的药物,申请人可在药物临床试验期间,评估该药物的适用范围和适用条件,向国家药品监督管理局药品审评中心提出申请。
药审中心关于拟突破性治疗品种公示截图此前的7月8日,国家药监局发布《突破性治疗药物审评工作程序(试行)》,该文件旨在鼓励研究和创制具有明显临床优势的药物,申请人可在药物临床试验期间,评估该药物的适用范围和适用条件,向国家药品监督管理局药品审评中心提出申请。
根据文件,药物临床试验期间,申请适用突破性治疗药物程序的,应当同时满足以下条件:
第一,用于防治严重危及生命或者严重影响生存质量的疾病。严重危及生命是指病情严重、不可治愈或者发展不可逆,显著缩短生命或者导致患者死亡的情形;严重影响生存质量是指病情发展严重影响日常生理功能,如果得不到有效治疗将会导致残疾、重要生理和社会功能缺失等情形。
第二,对于尚无有效防治手段的,该药物可以提供有效防治手段;或者与现有治疗手段相比,该药物具有明显临床优势,即单用或者与一种或者多种其他药物联用,在一个或者多个具有临床意义的终点上有显著改善。
此次入选的LCAR-B38M细胞制剂正式注册名字是西达基奥仑赛,是传奇生物开发的一款靶向B细胞成熟抗原(BCMA)的CAR-T疗法,用于既往接受过包括蛋白酶体抑制剂,免疫调节剂和抗CD38抗体的治疗方案和在末次治疗期间或之后出现疾病进展的复发或难治性多发性骨髓瘤(RRMM)成年患者。
该药在2018年获得国家药品监督管理局首个CAR-T临床试验申请(IND)批件,并于同年获得美国食品药品监督管理局(FDA)的IND批准。该产品已于2019年获得欧洲药品管理局优先药物认定(PRIME)资格及美国FDA授予的突破性疗法认定。
传奇生物成立于2014年,是从港股上市公司金斯瑞生物科技分拆出来,专攻CAR-T细胞免疫疗法。今年6月5日,传奇生物在纳斯达克挂牌交易,被称为“中国CAR-T上市第一股”。
值得一提的是,传奇生物在2017年就与强生旗下杨森公司(Janssen)达成战略合作,在全球范围内共同开发和推广西达基奥仑赛这一在研创新疗法。


