什么是化学键_一文解答

首先是离子键,它是通过电荷转移而形成两种带相反电荷的离子,这两种离子之间存在静电吸引力,这种力就称为离子键。
下面两张图依次代表Na原子和Cl原子。可以看到钠原子的最外层多出来一个电子(因为要达到最外层8个电子的稳定结构),而氯的最外层少了一个电子。所以这个时候,钠原子就会提供一个电子给氯,这样它们两个就都是8电子的稳定状态,它们之间的化学键就是离子键。
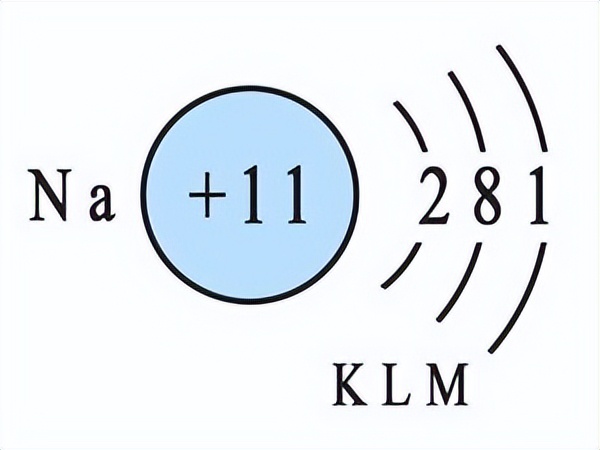
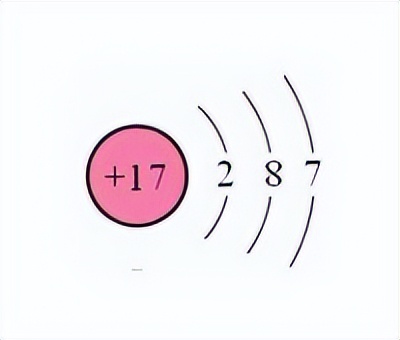
对于离子键的理解有如下特点:1.成键原子间的电负性相差较大。2.成键原子外层电子结构接近于八个电子或者两个电子。3.活泼金属与活泼非金属间常通过离子键作用形成分子。
接下来是共价键,它是通过成键原子间各提供一个电子,而共用一对电子形成的化学键。
比如下图中的氟原子和氢原子,它们的外层均缺少一个电子。所以他们之间共用一对电子,共用的这对电子既归氢所有,又归氟所有,从而达到稳定结构。
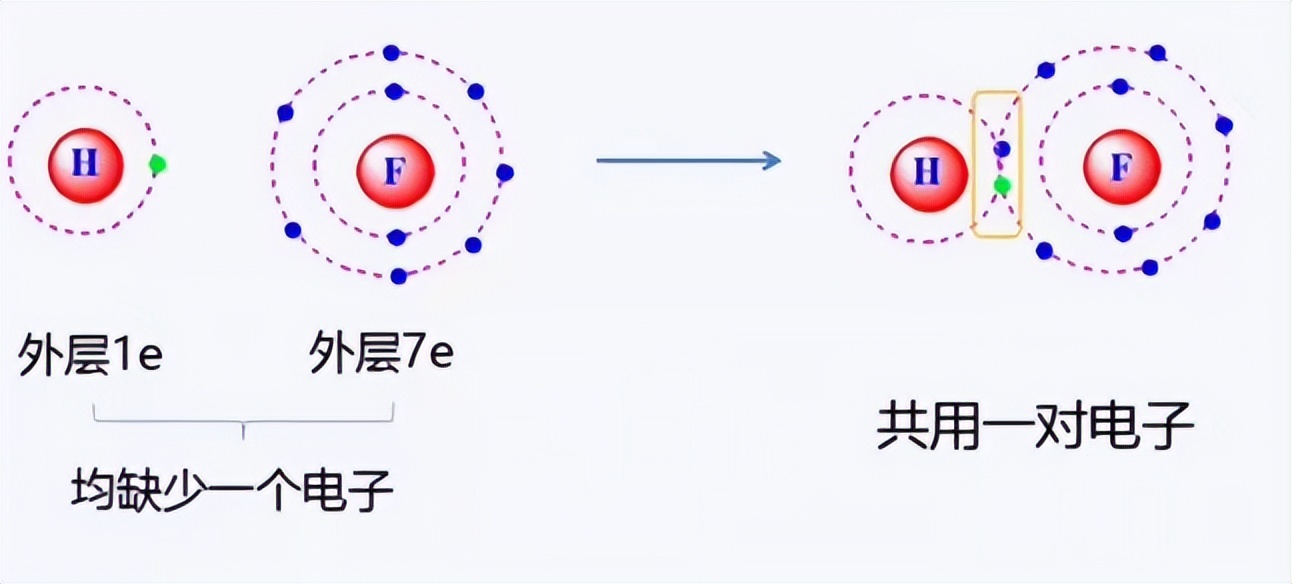
共价键的特点是成键原子的电负性相差不大。难以通过价电子转移达到外层八电子或两电子结构。成键原子间可通过共享电子对的方式达到稳定结构。
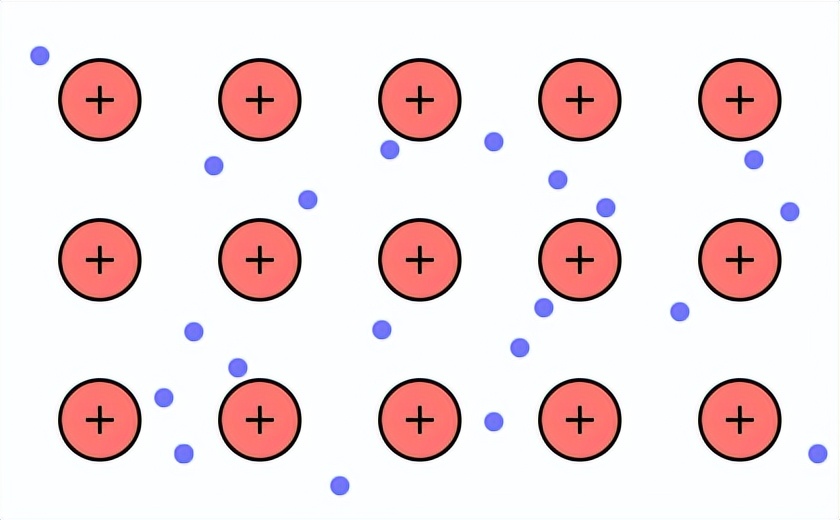
除了共价键以外还有,化学键中还包括金属键。金属键指的是金属阳离子和自由电子之间的较强的相互作用。在金属晶体中,每一个金属原子将其价电子(原子核外能与其它原他原子相互作用形成化学键的电子,不仅是是最外层电子)贡献出来。如下图所示,这些电子可以自由移动,组成电子气(可以认为是由电子组成的海洋),而金属离子反过来被“海洋”所吸引到一起,最终形成金属。
当然,共价键才是本文的重点。尽管之前对于共价键的形成进行了一定的解释,但是这一解释并没有触及到共价键形成的本质。如果从原子轨道论(参考前面的文章)的角度来研究共价键的形成,可以更好的理解其内在的原理。
我们知道共价键是共享电子来使外层达到稳定的两电子或八电子状态。但问题是两个原子的电子具体是一个怎么样的状态在一起?仅仅是简单的放在一起吗?
答案当然是否定的。我们假设现在有两个原子,它们的最外层均只有一个未成对电子,当然我不清楚具体是位于哪一个能层。没有关系,因为一个轨道上只能放两个自旋相反的电子,所以很清楚的是该原子多余的电子必然在一个轨道之上,如下图所示:
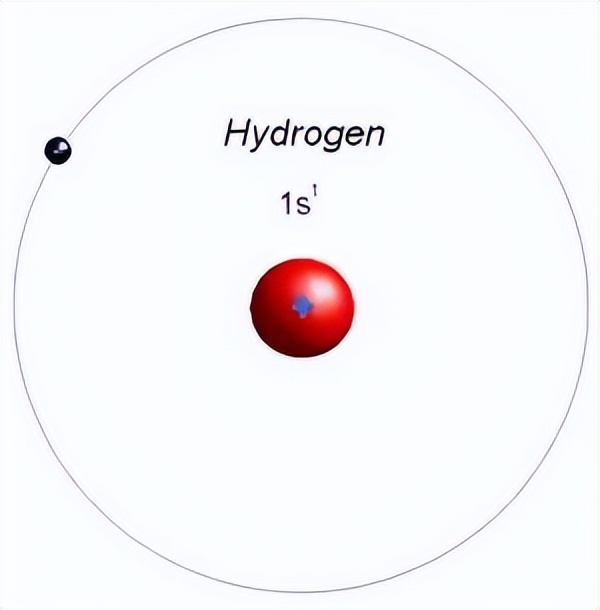
这是最简单的氢原子,最外层只有一个电子,当然它只有一个电子。两个氢原子组成氢气分子,则在各自轨道上的电子会以自旋相反的方式相互配对,形成稳定的共价单键,用一横来表示。

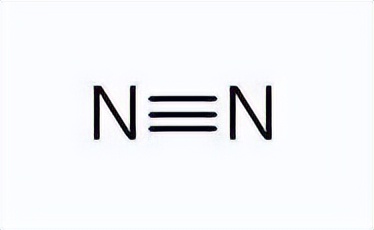
理解了这个接下来就是同理进行推导,即如果最外层各有两个或三个未成对的电子,那么以自旋相反进行一一配对。比如氮原子外面的电子总共有7个,那么进行分配1s上2个,2s上2个,还剩三个刚好在2px,2py,2pz这三个轨道上。那就是这三个电子与另外三个自旋相反的成单电子配对,形成共价三键。
在共价键中存在一种特殊的共价键,它的成键电子对在成键以前属于同一个原子,叫做配位键。配位共价键常用“→”来表示。以一氧化碳分子为例,对于碳原子和氧原子而言其第二层的电子排布如下:
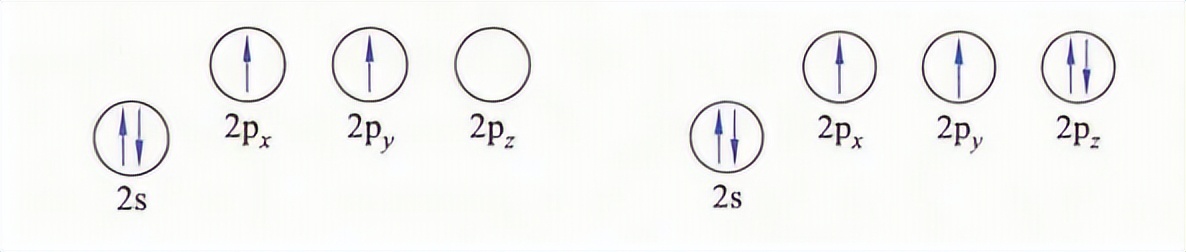
首先是碳原子和氧原子的两个成单的电子配对,之后氧原子中已成对的2pz电子和碳原子的空轨道再形成一个共价键。那么在这里前面两个共价键是普通共价键,而最后一个共价键则是配位共价键。
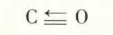
当然,在共价键形成以后,尽管其电子来源不同,但是键是没有任何区别的。
共价键具有饱和性和方向性。共价键的饱和性是指有几个未成对电子最多就会形成几个共价键。
方向性是重点。形成共价键时,原子轨道之间只有沿着一定的方向进行最大程度的重叠才可以。因为只有这样,才能保证成键原子轨道对称性的一致,且轨道的重叠度越大,则电子概率密度就越大,形成的共价键也就越稳定。
因为共价键轨道重叠方式不同,会形成不同类型的共价键。首先是σ键,它是电子云沿着键轴方向进行重叠,或者说头碰头的重叠方式。如下图所示,s轨道与s轨道,s轨道和p轨道,p轨道和p轨道都可以形成σ键。
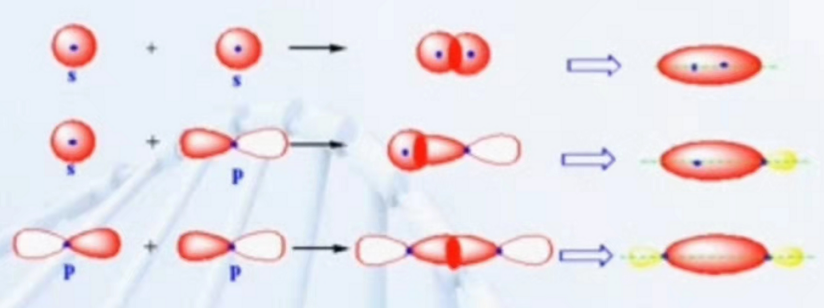
因为p轨道相互之间是垂直的,所以在两个p轨道沿着键轴方向进行重叠时,与它们相互垂直的p轨道就是以肩并肩的形式进行重叠的。这种重叠方式成为Π键。
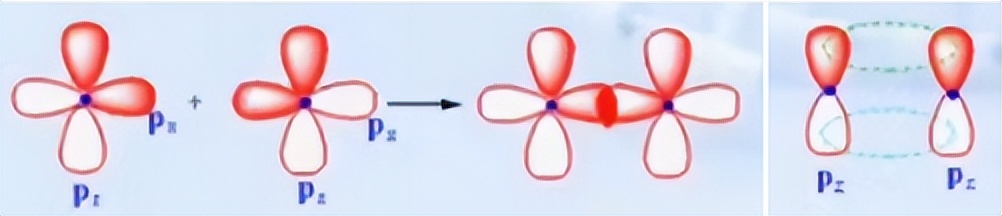
成键电子云沿键轴呈平面对称分布。以氮气分子为例,两个氮原子的px轨道沿x轴方向形成σ键,其余y和z方向的轨道则形成Π键。
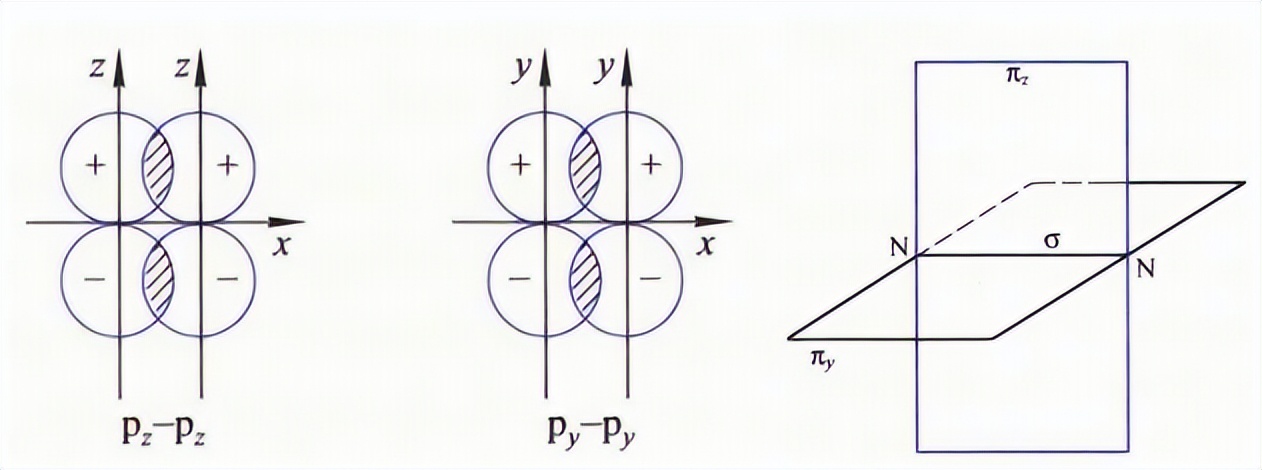
因为σ键的重叠程度比Π键大,所以其键能更强,稳定性也更好。


